Duisburg/Essen, 23. April 2024
Jährlich erleiden jeweils zwischen 250.000 und 300.000 Menschen in Deutschland einen Schlaganfall oder Herzinfarkt. Als Folge ist bei Betroffenen häufig auch das Immunsystem gestört und es kommt oft zu Infektionen, die lebensbedrohlich sein können. Bislang wusste man wenig über die zugrundeliegenden Mechanismen. Ein Forschungsteam aus Wissenschaftler:innen der Medizinischen Fakultät der Universität Duisburg-Essen, des Universitätsklinikums Essen und des ISAS hat nun eine bisher unbekannte Ursache aufdecken können – und einen Therapieansatz. Ihre Ergebnisse veröffentlichten sie in Nature Cardiovascular Research.
Geleitet wurde die Studie von Prof. Matthias Gunzer, Direktor des Instituts für Experimentelle Immunologie und Bildgebung (IEIB) an der Universität Duisburg-Essen (UDE) sowie Leiter der Abteilung Biospektroskopie am Leibniz-Institut für Analytische Wissenschaften (ISAS), und Dr. Vikramjeet Singh, Leiter der Schlaganfallgruppe im IEIB. Sie konnten zeigen, dass bei Menschen ein bis drei Tage nach einem Schlaganfall oder Herzinfarkt die Menge der IgA-Antikörper im Blut drastisch abnimmt – diese sind unverzichtbar für die Verteidigung gegen Infektionen. Antikörper gibt es in mehreren Unterarten, die zusammen als Immunglobuline (Ig) bezeichnet und im Darm in spezialisierten Zellen (Plasmazellen) hergestellt werden.
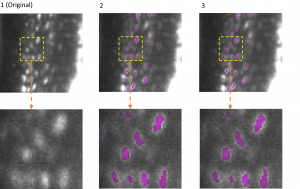
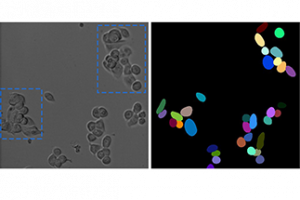
Um dem Mechanismus hinter dem Verlust der Antikörper auf die Spur zu kommen – und mit diesen Erkenntnissen die Behandlung von Patient:innen zu verbessern – griffen die Forschenden auf Maus-Modelle zurück. Auch bei Mäusen kam es nach einem Schlaganfall oder Herzinfarkt zu einem Verlust von IgA im Blut und Stuhl. Die Forschenden fanden heraus, dass DNA-Fasern ein bisher unbekannter Faktor für den Verlust der Immunabwehr sind. Diese als Neutrophil Extracellular Traps (NETs) bezeichneten DNA-Fasern stammen aus den Zellkernen einer anderen Immunzellart, den Neutrophilen. NETs werden nach einem Schlaganfall oder Herzinfarkt von stark aktivierten Neutrophilen in großer Menge ins Blut abgegeben und können die Plasmazellen im Darm direkt abtöten. Ein vermutlich noch wichtigerer Effekt der NETs ist die Bildung von hunderten kleinen Gerinnseln in den Blutgefäßen, die die Plasmazellen im Darm versorgen. Dadurch kommt es zu einer mangelnden Versorgung und die Ig-bildenden Zellen sterben in großer Zahl ab.
Den Immunologen und ihren Teams gelang es nicht nur, einen ursächlichen Zusammenhang zwischen Schlaganfall, Herzinfarkt und Immundefekt nachzuweisen, sie konnten auch einen neuen Behandlungsansatz aufzeigen: Wurden die NETs mit dem Enzym DNase zerstört oder ihre Freisetzung durch eine Substanz mit einem neuartigen Wirkprinzip verhindert, blieb die Immunabwehr intakt. Das konnten die Forschenden sowohl am Mausmodell als auch – im Fall der DNase – in späteren klinischen Studien nachweisen. „Bislang konnten keine Therapieansätze entwickelt werden, weil die Ursache für die Immunschwäche unklar war. Eine Behandlung, die die NETs abbaut oder gar ihre Bildung von vorneherein verhindert, könnte ein vielversprechender neuer Ansatz sein, um die Immunabwehr bei Patient:innen nach einem Schlaganfall oder Herzinfarkt zu erhalten. Möglicherweise lassen sich so schwere Folgeerkrankungen oder gar Todesfälle verhindern“, so Gunzer.
Originalpublikation
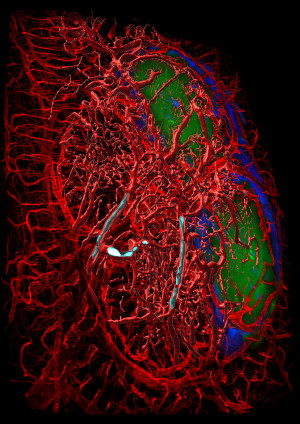
Fluoreszenz-Ultramikroskopische Aufnahme aus dem speziellen Darmgewebe einer Maus, das besonders viele Ig-produzierende Plasmazellen enthält: Rot sind Blutgefäße dargestellt, Immunzellen erscheinen grün (B-Zellen) bzw. blau (T-Zellen). Ein ischämischer Schlaganfall löste die Bildung von Gefäßthromben (grau) aus. Durch die anschließende Mangeldurchblutung sterben die Immunzellen ab.
© UDE/Laura Karsch und Ali Ata Tuz